今回は新シリーズとして中学校の理科を解説したいと思います。
小学校の時にはカンタンだった理科が、中学生に入った途端に難しくなっていきます。
まずは中学校3年生で最初に習う「 原子 の成り立ち」から解説していきたいと思います。
原子 の構造
そもそも 原子 とは何なのでしょうか?
原子は色々なものをうみだす小さな粒です。
例えば酸素や水といったものも原子の組み合わせから出来ています。
色んなものを作りだす小さな粒について学びましょうという範囲です。
では詳しい説明に入っていきましょう。
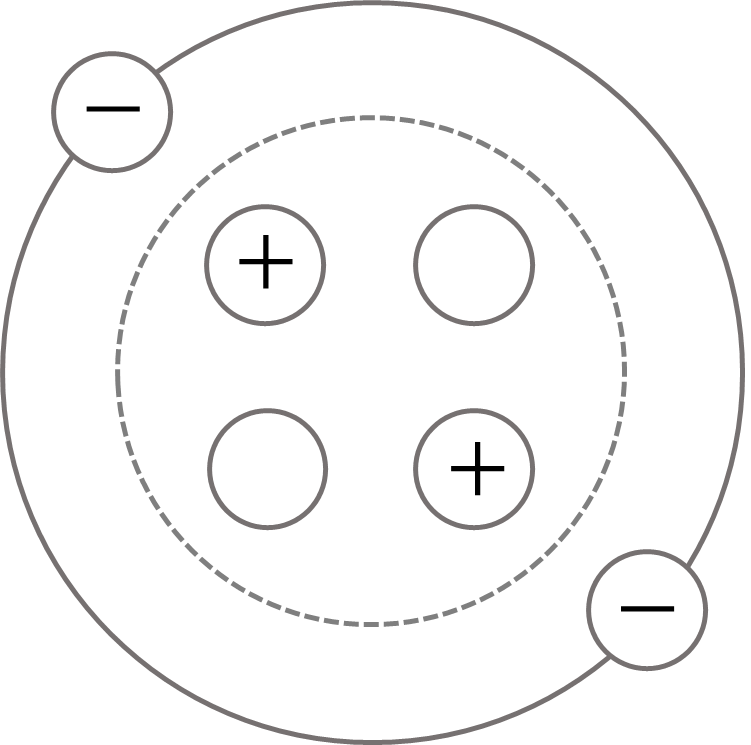
原子→ 原子核と電子(-)から成っています。
原子核→ 陽子(+)と中性子から成っています。
これはこういうものだと覚えておきましょう。
原子は粒のことを指しますが、原子の様々な種類を元素とも表現します。
中性子は元素の中で数が変わらないものもあります。
その一方で、
元素の中で中性子の数が異なるものを同位体と言います。
例えば水素だと中性子0個の水素と中性子1個の水素と中性子2個の水素があります。
ここも深く考えずに同位体という言葉だけ覚えておきましょう。
イオンはでんきタイプ
原子の構造について学びました。先ほど説明したように原子には陽子と電子が含まれています。
この中の電子が移動することで原子がイオンに変化します。
ポケモンがノーマルタイプからでんきタイプに変わるようなイメージです。
陽イオン=原子が電子を失って+の電気を帯びたもの
陰イオン=原子が電子を受け取って-の電気を帯びたもの
イオンは元素記号に+か−をつけることで表現します。
陽イオンであれば+、陰イオンであれば−です。
例
水素 H → 水素イオン H⁺
硫酸 SO₄ → 硫酸イオン SO₄²⁻
水に溶ける物質は電解質
このイオンというものを生かして物質ができあがります。
陽イオンと陰イオンがくっついて新しい物質をつくるのです。
この例が塩化ナトリウムです。(NaCl)
しかし塩化ナトリウムは水の中に入ると陽イオンと陰イオンに分かれてしまいます。
この動きのことを電離と言います。
こういった物質のことを電解質と言います。
動きのことを電離と言い、物質そのもののことを電解質と言います。
逆に水の中で陽イオンと陰イオンに分かれない物質を非電解質と言います。
英単語みたいに覚えよう!!
原子の成り立ちは言葉を覚えることが重要です。
言葉と意味を暗記してしまえば、それで終わりなので暗記してしまいましょう。
暗記が難しい場合には英単語みたいに覚えてみてください。
「原子」という言葉を見た時に「原子核と電子から成り立っているもの」と出てくるかどうか。
出てこなければ「原子→原子核と電子から成り立っているもの」とノートに10回書いてみてください。
覚えたと感じたら、1時間後に再度「原子」という言葉を見て脳内で「原子核と電子から成り立っているもの」と出てくるか試してみてください。
同位体や電解質といった他の言葉も同じやり方で覚えてみましょう。
とりあえず言葉と意味を覚えることがとても大事です。
いかがでしたでしょうか?
イオンはきっちり暗記をしておかないと点数が取れない範囲なので、覚えるべきところはしっかり覚えましょう。
ソヨギは他にも勉強のタメになる記事をたくさん公開しています。
興味があればぜひ読んでみてください!!
塾長